Equação de Clapeyron: o que é?
Com certeza, você já ouviu falar na chamada Equação de Clapeyron nas aulas de Química. Vamos relembrar o que é e entender um pouco mais sobre como pode ser cobrada? Estude com a gente!
Equação de Clausius Clapeyron
Também conhecida como a equação dos gases ideais, a Equação de Clapeyron foi desenvolvida pelo físico francês Paul Émile Clapeyron, com o objetivo de descrever o comportamento de um gás perfeito. Ela relaciona as três variáveis de estado — pressão, volume e temperatura — com a quantidade de partículas — mol — que compõem um gás.
Explicando a Equação de Clapeyron
A Equação de Clapeyron se dá da seguinte maneira:
pV = nRT
em que,
p = pressão exercida pelo gás
V = volume ocupado pelo gás
n = número de mol
T = temperatura em K
R = constante universal dos gases, que tem valores diferentes, dependendo das unidades de medida utilizadas:
![]()
Agora que você já sabe o que significa cada letra da equação, vamos resolver um exercício!
Exercício sobre equação de Clapeyron
1. (UFRJ) Necessita-se armazenar certa quantidade de oxigênio gasoso (O2). A massa de gás é de 19,2 g, à temperatura de 277 oC e à pressão de 1,50 atm. O único recipiente capaz de armazená-lo terá aproximadamente o volume de:
Dados: O = 16g/mol, R = 0,082 atm.L/mol.K
Resolução:
pV = nRT
O exercício pede: valor de V.
Já nos foram dados os valores de: p, T, R, e a massa do gás. Mas cuidado para não substituí-los na equação com a unidade errada!
Em muitos exercícios, a temperatura é fornecida em graus Celsius (°C), mas a Equação de Clapeyron exige que ela seja usada em Kelvins (K). Atente também à unidade de pressão, para saber qual valor de R usar!
Temperatura em K
T(K) = 273 + T(°C)
T = 273 + 277 = 550K
Para conseguirmos substituir todos os valores na equação, deixando apenas o volume como incógnita, precisamos calcular o número de mol. Para isso, utilizaremos a massa de gás fornecida.
Número de mol
![]()
Note que utilizamos aqui o valor da massa molar igual a 32, não 16 como foi dado no exercício. É necessário fazer isso porque o valor de 16 é para cada átomo de O. Como o gás oxigênio é composto por dois átomos, multiplica-se 16 por 2.
Temos, agora, todos os valores de que precisamos para resolver o exercício.
Cálculo do volume
Isolando V na Equação de Clapeyron, temos:
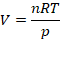
Substituindo os valores, temos:
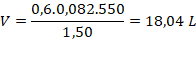
A Química é mesmo fascinante! Para continuar revendo temas importantes para as provas do Enem e de vestibulares, faça um Plano de Estudos personalizado e arrase nas provas!