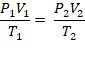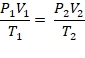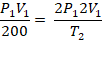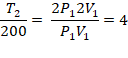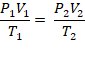Equação Geral dos Gases: Entenda a Fórmula e Aplicações
Uma matéria bastante estudada em Química e cobrada nos vestibulares é a dos gases. Por serem capazes de passar por diferentes transformações, o estudo de seu comportamento é essencial. Aprenda mais sobre o assunto aqui!
Estudo dos gases
Um gás pode sofrer variações em seu volume, temperatura e pressão.
As transformações gasosas podem ser:
- Isobáricas: variações de volume e temperatura, a pressão constante.
- Isotérmicas: variações de volume e pressão, a temperatura constante.
- Isovolumétricas ou isométricas ou isocóricas: variações de temperatura e pressão, a volume constante.
O comportamento dos gases foi estudado por três cientistas: Robert Boyle, Joseph Louis Gay-Lussac e Jacques Alexandre César Charles. Unindo as equações desenvolvidas pelos três, chegou-se à equação geral dos gases, dada por:
em que, P1, V1 e T1 são a pressão, o volume e a temperatura antes das transformações, e P2, V2 e T2, após as transformações.
Equação geral dos gases perfeitos
A equação geral dos gases perfeitos é a conhecida Equação de Clapeyron. Visando descrever o comportamento desses gases, ela relaciona as variáveis de estado da equação geral dos gases com a quantidade de mol de um gás. Está representada a seguir:
pV = nRT
em que:
p = pressão
V = volume
n = número de mol
T = temperatura
R = constante universal dos gases:
Gráfico da equação geral dos gases
Como vimos, os gases podem sofrer três tipos de transformações, e para cada uma delas há um tipo de gráfico:
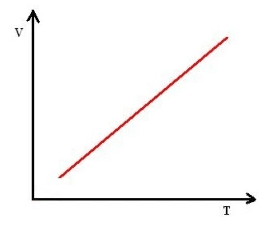
Isobárica: volume em função da temperatura
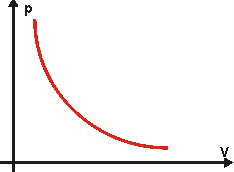
Isotérmica: pressão em função do volume
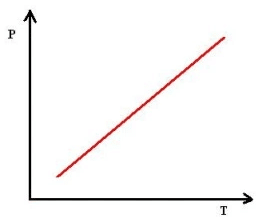
Isovolumétrica: pressão em função da temperatura
Equação geral dos gases: exercícios
1. (UF-AC) Qual deve ser a temperatura de certa quantidade de um gás ideal, inicialmente a 200 K, para que tanto o volume quanto a pressão dupliquem?
a) 1200 K.
b) 2400 K.
c) 400 K.
d) 800 K.
e) n.d.a.
Resolução:
T2 = 800 K
Resposta: letra d
2. (Unirio-RJ) O uso do amoníaco, NH₃, nos cigarros aumenta o impacto e o efeito da nicotina. “com esse estudo confirmamos o que antes desconfiávamos: as empresas manipulam a quantidade de amoníaco com o propósito de reforçar a nicotina, disse o deputado Henry Waxman (EUA)”.
Suponha que uma amostra de cigarro contenha 5 mL de NH₃, a 27 °C. Se aquecermos o cigarro a 627 °C, mantendo a pressão constante, o volume de NH₃, em L, será de:
a) 150.
b) 15.
c) 0,15.
d) 0,015.
e) 0,0015.
Resolução:
Como a pressão é constante
V1/T1 = V2/T2
Dados: T1 = 27 °C = 300 K
T2 = 627 °C = 900K
V1 = 5 mL = 0,005 L
0,005/300 = V2/900
V2 = 0,015 L
Resposta: letra d
A equação geral dos gases ajuda a resolver uma série de problemas em Química! Agora que você já aprendeu sua fórmula, que tal testar seus conhecimentos em nosso banco de questões?